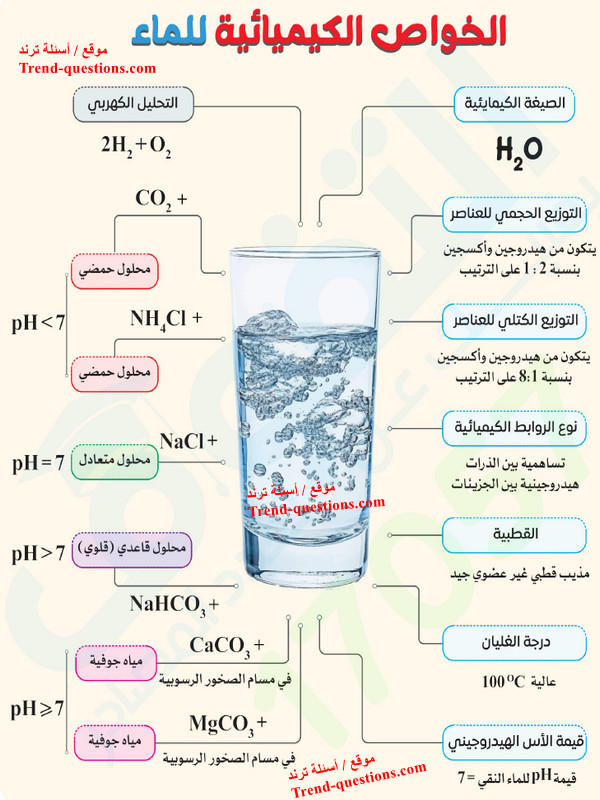
التركيب الكيميائي للماء
- يتركب الماء من عنصرين هما الهيدروجين والأكسجين بنسبة 2:1 حجمًا على الترتيب.
- يمثل الأكسجين %88.89 من كتلة جزىء الماء ويمثل الهيدروجين نسبة %11.11.
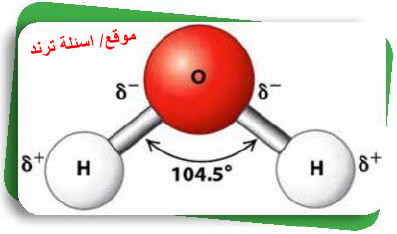
- ترتبط ذرتي الهيدروجين بذرة الأكسجين بأثنتين من الروابط التساهمية تحصران بينهما زاوية قياسها حوالي 104.5o
الخواص الكيميائية للماء
- لا يوجد الماء على سطح الأرض في صورة نقية حيث يحتوي على العديد من الأيونات والمواد الكيميائية التي تتفاعل معه بطرق مختلفة.
- سوف نستعرض منها ثلاثة من الخواص الرئيسية للماء هي : القطبية - التحلل المائي (التميؤ) - التوازن الحمضي / القاعدي
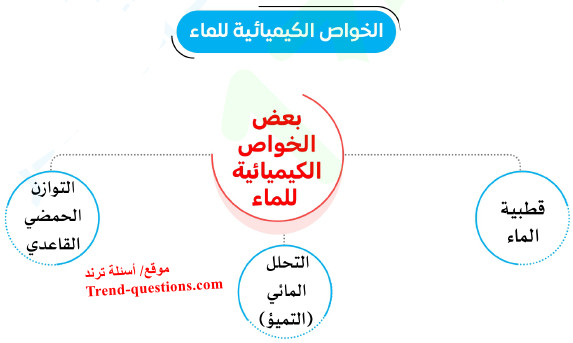
(1) قطبية الماء
- تتميز ذرة الأكسجين بارتفاع سالبيتها الكهربية عن ذرة الهيدروجين، ولذلك تنجذب إلكترونات الرابطة تجاه ذرة الأكسجين مكونة شحنة سالبة جزئية على ذرة الأكسجين (-δ) وشحنة موجبة جزئية على ذرة الهيدروجين (+δ)، وهو ما يُعرف بقطبية جزئ الماء.
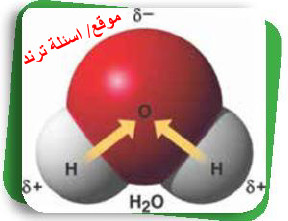
- يترتب على قطبية جزيئات الماء ارتباطها بجزيئات الماء الأخرى فيما يسمى بالروابط الهيدروجينية أو الجزيئات القطبية لمواد أخرى، مما يعطي الماء القدرة على إذابة الكثير من الأملاح وتفكيكها إلى أيونات متهدرتة.
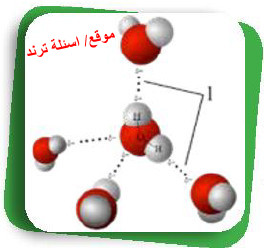
- أيضًا تُعد قابلية جزيئات الماء على تكوين روابط هيدروجينية فيما بينها سببًا أساسيًا في ارتفاع درجة غليان الماء النقي التي تصل إلى 100Co تحت الضغط الجوي المعتاد مقارنة بدرجة غليان المركبات المماثلة له في التركيب، مثل كبرتيد الهيدروجين الذي يغلي عند 61Co - .

(2) التحلل المائي (التميؤ)
- توجد نسبة ضئيلة من جزيئات الماء في صورة أيونات هيدروجين (+H) وأيونات هيدروكسيد (OH-).
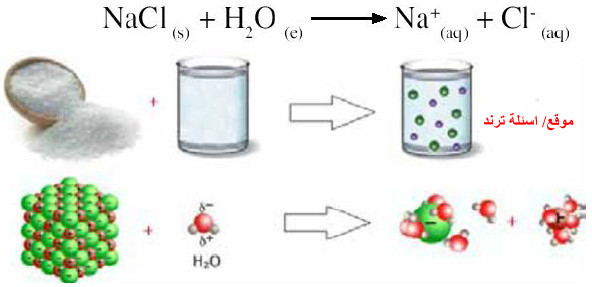
- نتيجة التفاعلات الكيميائية مع المركبات المختلفة يحدث تحلل مائي لبعض الأملاح الموجودة في المياه الطبيعية ، ويؤثر ذلك على توازن هذه الأيونات مما يتسبب في حموضة أو قاعدية الماء.
- مثال: عند إضافة ملح الطعام NaCl يتفكك إلى أيون الصوديوم (+Na) وأيون الكلوريد (-Cl).
(3) التوازن الحمضي - القاعدي
- يعتمد التوازن الحمضي - القاعدي في الماء على العلاقة بين تركيز أيونات الهيدروجين (+H) وأيونات الهيدروكسيد (OH-).
- يمكن التعرف على هذه العلاقة من خلال قيمة ما يسمى بالرقم الهيدروجيني (pH) للمحلول.
- الرقم الهيدروجيني (pH) هو مقياس متدرج يتخذ القيم من 0 إلى 14. فإذا زاد تركيز +H يصبح الماء حمضياً وتكون قيمة pH أقل من 7، وإذا زاد تركيز OH- يصبح الماء قاعديًا وتكون قيمة pH أكبر من 7. بينما إذا كان تركيز الأيونين متساوياً يكون الماء متعادلاً وتكون قيمة pH تساوى 7.
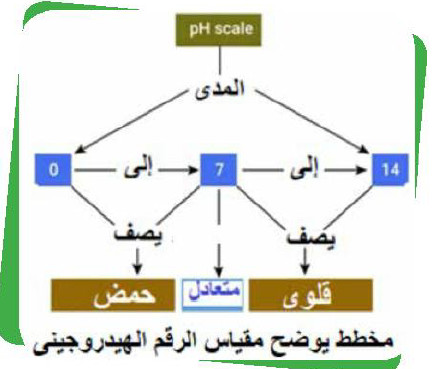
- الرقم الهيدروجيني :(pH) هو مقباس يعبر عن حموضة أو قاعدية المياه
- المياه النقية لها pH حوالي 7، وهو يعتبر متعادلاً. لكن هذا الرقم قد يختلف في البيئات الطبيعية، مما يؤثر على الكائنات الحية التي تعيش فيها.
قيمة pH للماء من مصادر مختلفة
(1) ماء البحار
- تتراوح قيمة pH لماء البحار بشكل عام بين 7.5 إلى 8.4 حسب المنطقة التي يقع بها البحر، والعوامل البيئية المحيطة به.
(2) الماء العذب (الأنهار والبحيرات)
- تختلف قيمة pH وتتراوح عادة بشكل طبيعي بين 6.5 إلى 8.5
(3) الماء المقطر
- تبلغ قيمة pH حوالي 7 لأنها خالية من معظم الشوائب والأيونات التي تساهم في حموضة أو قاعدية مصادر المياه الطبيعية الأخرى.
(4) المياه الجوفية
- يختلف الرقم الهيدوجيني للمياه الجوفية من منطقة إلى أخرى تبعًا لعدة عوامل أهمها التركيب الصخري بالمنطقة.
- تكون المياه الجوفية إما متعادلة أو قاعدية، وتختلف قيمة pH لها بسبب التعرض لصخور كربونات الكالسيوم أو كربونات الماغنسيوم.
(5) السحب
- يكون الرقم الهيدروجيني pH للسحب حمضيًا قليلاً بشكل عام، حيث تتراوح القيم من 4.5 إلى 5، وذلك بسبب وجود غاز ثاني أكسيد الكربون والغازات الحمضية الأخرى الذائبة في قطرات الماء.
- هذه القيم يمكن أن تختلف اعتمادًا على عوامل بيئية مختلفة، والأنشطة البشرية في تلك المنطقة والتي يمكن أن تؤثر على مستوى الرقم الهيدروجيني عند تكوين السحب أو مياه الأمطار.
- ويمكن تلخيص الخواص الكيميائية للماء فى هذا المخطط الرائع كما يلي: